Дистанційне навчання
| 10.11.2022, 10:50 AM | |
|
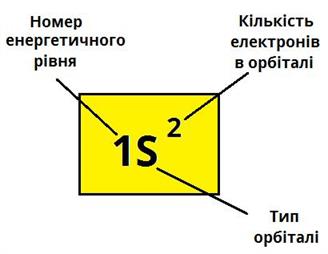
Теорія Будь-яку орбіталь спрощено зображають квадратом:
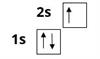
На кожній орбіталі може перебувати один або два електрони. Якщо на орбіталі міститься один електрон, то він неспарений. Два електрона на одній орбіталі називають спареними. Електрони на орбіталі рухаються навколо власної осі. Цей рух називається спіном. Рух електронів відрізняються напрямком руху — один електрон рухається за годинниковою стрілкою — має позитивний спін, інший — проти годинникової стрілки — має негативний спін. Електрони на орбіталі зображають стрілкою. Неспарений електрон:
Спарені електрони позначають на орбіталі протилежно спрямованими стрілками:
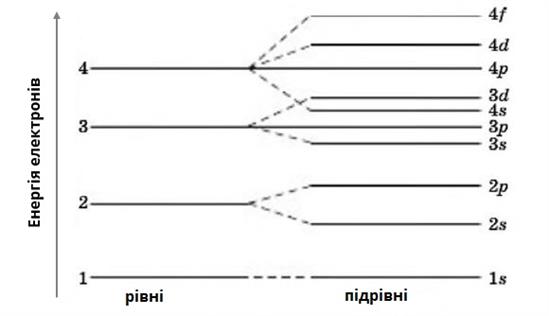
Одною з найважливіших характеристик електрона є його енергія. Величина енергії залежить від того, на якій відстані від ядра рухається електрон. Найменшу енергію має електрон, який розташовується найближче до ядра атома. По мірі віддалення від ядра енергія електрона збільшується. Віддаль від ядра, на якій є найбільш імовірне перебування електрона, називають енергетичним рівнем. Кількість енергетичних рівнів у електронній оболонці атома визначають за номером періоду, в якому міститься елемент. Наприклад, Карбон — елемент 2 періоду, тому електрони в атомі цього елемента містяться на двох енергетичних рівнях. Кальцій — елемент 4 періоду, отже електрони в атомі цього елемента розташовані на чотирьох енергетичних рівнях.
Енергетичні рівні складаються з підрівнів, причому номер рівня вказує на кількість підрівнів. Наприклад, у першого рівня є один підрівень, у другого — два підрівня, у третього — три і т.д.
Розподіл електронів за енергетичними рівнями Заповнення електронами енергетичних рівнів записується електронними формулами. В атомі Гідрогену є один енергетичний рівень, на якому міститься один електрон:
записується: 1s1, де на початку зазначається номер енергетичного рівня, далі вказується форма орбіталі і кількість електронів на ній.
Електронна формула
Елемент Гелій має один енергетичний рівень, на якому містяться два електрони:
Електронна оболонка Гелію — 1s2. В атомі Літію — три електрони. Елемент міститься у другому періоді, в його атомі — два енергетичні рівні. Оскільки перший рівень вмішує лише два електрони, третій електрон займе s-орбіталь другого енергетичного рівня:
Формула електронної оболонки Літію: 1s22s1. Енергетичні рівні нумерують, починаючи з найближчого до ядра. Встановлено, що максимальне число електронів на енергетичному рівні дорівнює 2n², де n — його номер. Отже, на першому рівні може перебувати не більше 2 електронів, на другому — не більше 8, на третьому — не більше 18, тощо. На першому енергетичному рівні містяться лише s-електрони. На другому енергетичному рівні — s− і p−електрони. На третьому енергетичному рівні — s−, p− і d−електрони. На четвертому і наступних енергетичних рівнях — s−, p−, d− і f−електрони.
Розташування орбіталей на підрівнях В електронно-графічних формулах s−орбіталь позначають одним квадратиком:
У р−електронів електронні хмари можуть бути розташовані по осях x, y і z , тобто існують px, py і pz орбіталі. Тому на p−підрівні в електронно-графічних формулах малюють три клітинки:
Для d−електронів існує п'ять можливих розташувань d−орбіталей:
Для f−електронів існує сім можливих розташувань f−орбіталей:
Якщо в атомі заповнюється p−, d− або f−підрівні, то розподіл електронів відбувається наступним чином: спочатку в кожну клітинку пишуть по одному електрону:
Кількість електронів на зовнішньому рівні атома елемента головної підгрупи дорівнює номеру групи, у якій міститься елемент. | |
|
| |
| Переглядів: 136 | Завантажень: 0 | | |
| Всього коментарів: 0 | |