Дистанційне навчання
| 04.21.2022, 8:54 AM | |
|
Опис презентації окремими слайдами:
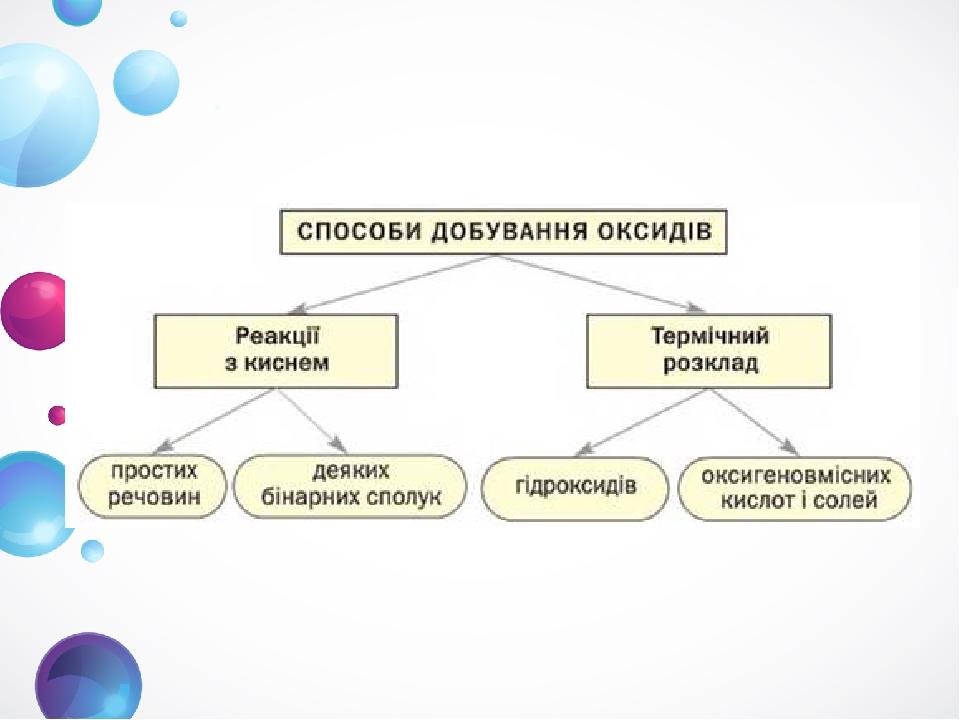
СЛАЙД № 1 СПОСОБИ ДОБУВАННЯ ОКСИДІВ ТАТАРЧУК Н.О.
СЛАЙД № 2 ПЛАН УРОКУ Click to add Title 1 РЕАКЦІЇ ПРОСТИХ РЕЧОВИН ІЗ КИСНЕМ 1 Click to add Title 2 РЕАКЦІЇСКЛАДНИХ РЕЧОВИН ІЗ КИСНЕМ 2 Click to add Title 1 ТЕРМІЧНИЙ РОЗКЛАД ГІДРОКСИДІВ ТА ОКСИГЕНОВМІСНИХ КИСЛОТ 3 Click to add Title 2 ТЕРМІЧНИЙ РОЗКАД ОКСИГЕНОВМІСНИХ СОЛЕЙ 4 Click to add Title 1 ДОБУВАННЯ ОКСИДІВ У ПРОМИСЛОВОСТІ 5
СЛАЙД № 3 Реакції простих речовин із киснем. Цікаво знати Із киснем не реагують золото, платина, інертні гази, хлор, бром, йод.
СЛАЙД № 4 Реакції складних речовин із киснем. Сполуки Купруму, Цинку, Кадмію, деяких інших елементів із Сульфуром містяться в поліметалічних рудах. Ці руди обпалюють на металургійних заводах, а з оксидів, що утворюються, добувають метали.
СЛАЙД № 5 Термічний розклад гідроксидів та оксигеновмісних кислот Нерозчинні основи, амфотерні гідроксиди та оксигеновмісні кислоти при нагріванні розкладаються на відповідні оксиди
СЛАЙД № 6 Термічний розклад гідроксиду купруму(міді)
СЛАЙД № 7 Термічний розклад оксигеновмісних солей
СЛАЙД № 8
СЛАЙД № 9 Добування оксидів у промисловості. На відміну від лабораторних способів добування різних сполук промислова технологія передбачає використання реагентів у великих кількостях і висуває такі вимоги: 1. Вихідні речовини мають бути доступними й дешевими. Найкраще застосовувати природну сировину. 2. Енерговитрати при підготовці та здійсненні хімічних реакцій повинні бути мінімальними.
СЛАЙД № 10 CaCO₃→CaO + CO₂↑ 900 °C Природних покладів вапняку дуже багато; це доступна і дешева речовина. Температура, за якої розкладається вапняк, не надто висока для промисловості (наприклад, у металургії створюють температуру 1500 °С і вище). При слабшому нагріванні розклад вапняку уповільнюється або припиняється. 2(CaSO4 · 2Н2О) =t 2СаО + 2SO2↑ + Ο2↑ + 4Η2O↑. Гіпс, хоч і є природною речовиною, дорожчий за вапняк, а температура його розкладу значно вища за 900 °С.
СЛАЙД № 11 Розв′язання завдань та задач 1.Запропонуйте якомога більше способів добування цинк оксиду. Напишіть рівняння відповідних реакцій. 2. Укажіть у поданому переліку формули сполук, які розкладаються при нагріванні: H2SiO3, CuSO4, Fe(PO3)3, NaOH, MgCO3, Pb(OH)2, Н3ВO3. Напишіть відповідні хімічні рівняння. 3.Обчисліть об’єми оксидів Карбону(ІV) і Сульфуру(ІV) (у перерахунку на нормальні умови), які утворюються при згорянні 19 г карбон(IV) сульфіду в надлишку кисню. 4. Після прожарювання 2,32 г магній гідроксиду маса твердого залишку становила 1,60 г. Чи повністю розклалася сполука?
СЛАЙД № 12 ДОМАШНЄ ЗАВДАННЯ § 33 Відображення документу є орієнтовним і призначене для ознайомлення із змістом, та може відрізнятися від вигляду завантаженого документу. | |
|
| |
| Переглядів: 156 | Завантажень: 0 | | |
| Всього коментарів: 0 | |